پارامترهای pH و قلیائیت (Alkalinity) دو شاخصی هستند که نزدیکی و وابستگی زیادی با یکدیگر دارند و شناخت شباهت، تمایز و همچنین نوع رابطه آنها از اهمیت بالایی برخوردار است. در این مقاله، به تعریف دقیق این دو شاخص و نوع رابطه آنها با یکدیگر به صورت کامل پرداخته خواهد شد.
مقادیر pH و قلیائیت آب به پارامترهای متعددی از جمله موارد زیر بستگی دارد:
- منبع آب (آب تصفیه شده یا آب چاه)
- موقعیت جغرافیایی و نوع بستر زمین منطقه
- باران های اسیدی
- انجام فعالیت های معدنی در منطقه
- وجود دفن زباله، کارخانه صنعتی و یا ایستگاه گاز در منطقه
- نوع فرآیند تصفیه آب
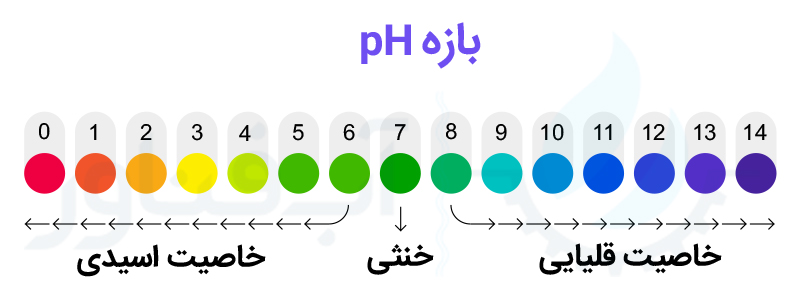
مقدار شاخص pH مخفف عبارت potential of Hydrogen بوده و نشانگر میزان خاصیت اسیدی و یا بازی بودن آب است. مقدار pH بر اساس تعداد یون های هیدروژن (+H) در آب اندازه گیری می شود. شاخص pH بصورت یک عدد بدون واحد و در بازه 0 تا 14 بیان می شود.
پارامتر pH یکی از مهمترین شاخص های کیفیت آب است. زیرا برخی از واکنش های شیمیایی مهم در آب تنها در بازه های معینی از pH اثربخشی قابل قبولی دارند. به عنوان مثال، اثربخشی ضدعفونی کلر در آب، در pH بین 6.5 تا 8 به حداکثر خود می رسد. این میزان اثربخشی در pH=8 حدود 20% و در pH=7 حدود 66% است.
میزان خاصیت اسیدی یا بازی آب که با عدد pH بیان می شود، در واقع مقایسه میزان یون های +H و -OH در آب است. هر چه میزان یون های +H نسبت به -OH در آب بیشتر باشد، pH آب کمتر بوده و آب خاصیت اسیدی بیشتری دارد. بر عکس، هرچه تعداد یون های -OH بر یون های +H غلبه داشته باشند، آب خاصیت بازی بیشتری داشته و pH آن بالاتر خواهد بود. در مقدار pH عدد 7 تعداد یون های +H و -OH یکسان بوده و آب در حالت خنثی قرار دارد. اما در pH بالای 7 با بیشتر بودن یون های -OH آب خاصیت بازی داشته و بر عکس در pH کمتر از 7 با بیشتر بودن یون +H نسبت به -OH، خاصیت اسیدی آب افزایش می یابد.
نکته مهم قابل توجه دیگر این است که مقیاس pH بصورت لگاریتمی است. یعنی اگر pH یک ماده به میزان یک واحد کم شود، خاصیت اسیدی آن ده برابر بیشتر افزایش پیدا می کند. به همین ترتیب، میزان اسیدی بودن یک ماده باکاهش دو واحد pH، صد برابر بیشتر خواهد شد.
قلیائیت شاخصی است برای میزان ظرفیت آب برای خنثی سازی اسید. این شاخص بر حسب میلی گرم بر لیتر یا ppm اندازه گیری شده و معمولاً بر اساس مقدار مولکول های "دی اکسید کربن" (CO2) و یون های "بی کربنات" (-HCO3)، "کربنات" (--CO3) و "هیدروکسید" (-OH) در آب اندازه گیری و تعیین می شود.
وجود مقدار بالای این یون ها در آب باعث می شود که علیرغم اضافه کردن اسید، یون های +H بجای آنکه بصورت آزاد در آب رها شده و pH آب را کاهش دهند، صرف واکنش با مولکول ها و یون های قلیائیت شوند. به همین دلیل، قلیائیت در واقع نشانگر میزان مقاومت در برابر تغییر pH است. بنابراین، برای کاهش pH آبی که قلیائیت بالایی دارد نیاز به اسید بیشتری نسبت به آب با قلیائیت کمتر است. به عنوان مثال، اضافه کردن یک قطره اسید به آب مقطر (که عاری از قلیائیت است) می تواند pH آن را از عدد 7 به عدد 2 برساند. در حالیکه شاید اگر به همان مقدار آب چاه با املاح زیاد، حدود 200 تا 300 ppm اسید هم اضافه شود، نهایتاً pH آن از عدد 7 به عدد 6 برسد!
مقدار وجود هر یک از این یون ها در آب بستگی به مقدار pH آب دارد که در شکل زیر مشخص شده است:
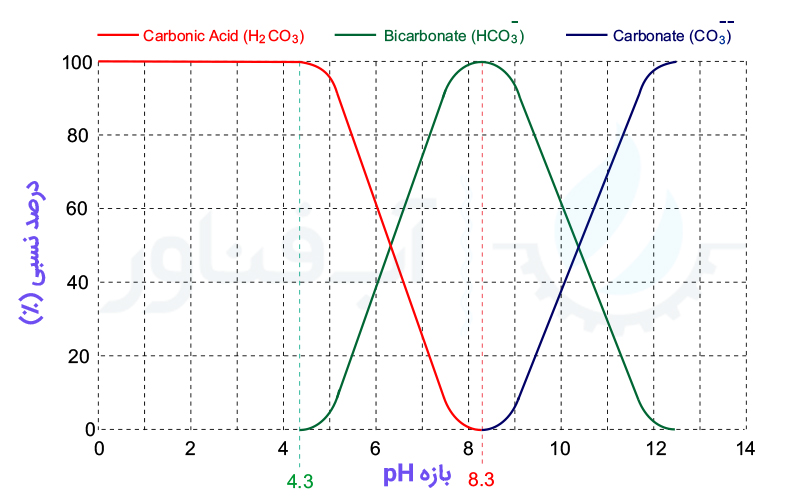
قلیائیت در آب از pH = 4.3 شروع می شود. به عبارت دیگر، مقدار قلیائیت در pH زیر 4.3 برابر صفر است. از pH بین 4.3 تا 8.3، دی اکسید کربن و بی کربنات در قالب واکنش شیمیایی زیر در حال تبدیل به یکدیگر هستند:
CO2 + H20 ↔ H+ + HCO3 -
از pH=8.3 به بعد، یون های بی کربنات در طی واکنش زیر شروع به تبدیل شدن به یون های کربنات می کنند:
HCO3-- ↔ H+ + CO3 --
در pH=12 به بعد، یون های هیدروکسید در آب تولید می شوند.
همانطور که گفته شد و در واکنش های نشان داده شده مشخص است، در قلیائیت بالا، زمانی که اسید به آب برای کاهش pH اضافه می شود، بجای افزایش مقدار یون H+ در آب، اسید صرف واکنش با یون های هیدروکسید، کربنات و بی کربنات می شود. مخصوصاً در pH بالای 12 با توجه به حضور یون های هیدروکسید (OH-) در آب و واکنش آنها با یون های H+ آزاد شده اسید، حجم اسید مورد نیاز برای کاهش pH بسیار زیاد خواهد شد. از طرفی در مقادیر pH خیلی پایین نیز، با توجه به حجم بالای یون های H+، کاهش pH نیاز به مقدار اسید زیادی دارد.
کنترل میزان pH و قلیائیت، نقش مهمی در کیفیت آب استخر دارد. کم بودن و یا زیاد بودن هر کدام از این پارامترها می تواند تأثیرات نامطلوبی روی کیفیت آب، شناگران و تجهیزات استخر داشته باشد. تنظیم pH و قلیائیت در محدوده مورد نظر باعث افزایش اثربخشی مواد ضدعفونی کننده (از جمله کلر)، جلوگیری از خورندگی و همچنین رسوب گذاری آب روی سطوح و تجهیزات می شود.
همانطور که گفته شد، قلیائیت باعث تثبیت و مقاومت در برابر تغییر pH شده و همینطور بر خاصیت رسوب گذاری آب نیز تأثیر می گذارد. مقدار pH مناسب آب استخر بین 7.6-7.2 و مقدار مطلوب قلیائیت کل نیز بین 80-120 ppm در نظر گرفته می شود.
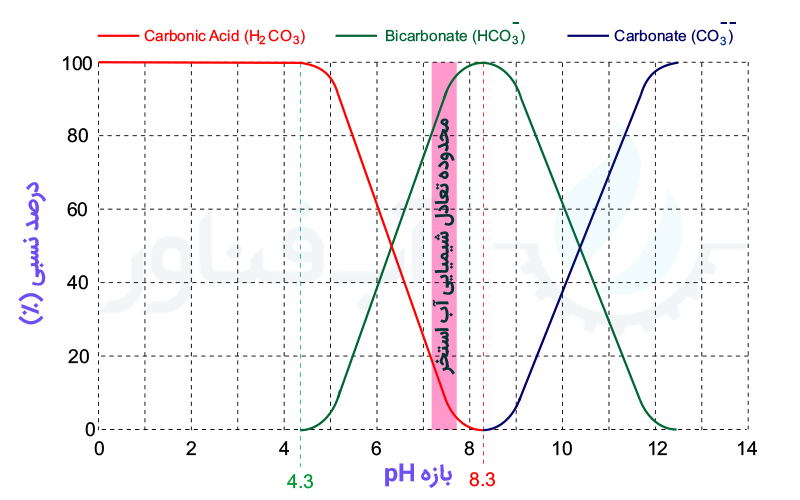
همانطور که در شکل فوق ملاحظه می شود، در این محدوده بیشترین سهم قلیائیت مربوط به یون "بی کربنات" بوده و واکنش شیمیایی زیر بصورت تعادلی در آب برقرار است:
CO2 + H20 ↔ H+ + HCO3 -
برای افزایش و یا کاهش pH و قلیائیت در آب استخر از مواد شیمیایی مخصوص و یا بصورت کلی از اسید برای کاهش و از بی کربنات سدیم و یا جوش شیرین برای افزایش این پارامترها استفاده می شود.
میزان pH و قلیائیت آب استخر، تأثیر مستقیمی روی میزان رسوب گذاری آب بر روی سطوح و تجهیزات نیز دارد. البته در رسوب گذاری عوامل متعددی تأثیرگذار هستند. پارامتری به نام شاخص لانژلیه (Langelier Index) تعریف شده است که میزان رسوب گذاری را با توجه به چهار عامل pH، "قلیائیت"، "سختی کل" و "دما" نشان می دهد.
. نحوه محاسبه شاخص لانژلیه، مطابق فرمول زیر می باشد:
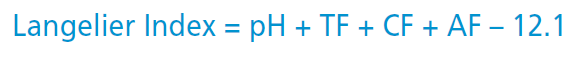
در این فرمول:
pH: عدد pH مستقیماً در فرمول قرار می گیرد.
TF، CF و AF: به ترتیب نشاندهنده دما، سختی کلسیمی و قلیائیت کل هستند که اعداد آنها جهت استفاده در فرمول فوق، از جدول زیر استخراج می شوند:
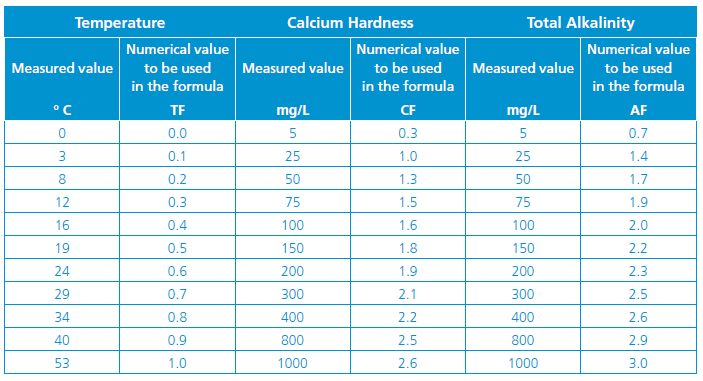
با استفاده از اطلاعات و اعداد فوق و پس از محاسبه شاخص لانژلیه (LI)، می توان وضعیت تعادل شیمیایی آب را با توجه جدول زیر تحلیل نمود:
| مقدار شاخص لانژلیه (LI) | وضعیت تعادل شیمیایی آب (از نظر رسوب گذاری) |
| صفر | ایده آل |
| بین -0.5 و +0.5 | مطلوب |
| کمتر از ضفر | آب تمایل به خورندگی دارد. |
| بیشتز از صفر | آب تمایل به رسوب گذاری دارد. |
از منحنی زیر نیز می توان برای پیش بینی میزان رسوب گذاری و یا خورندگی آب با توجه به مقادیر pH و قلیائیت می توان استفاده نمود:
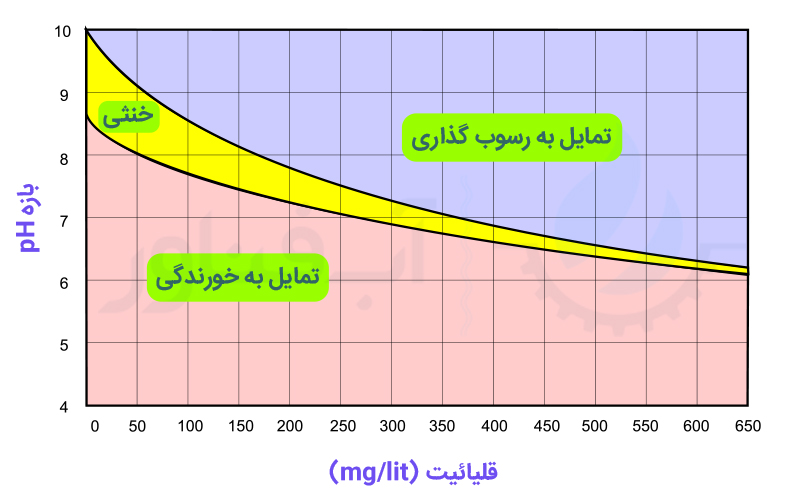
یکی از مهمترین عوامل افزایش قلیائیت آب استخر، استفاده از سیانوریک اسید و یا کلرهای حاوی مواد تثبیت کننده است. مواد استفاده شده در ترکیب این کلرها پس از انحلال در آب باعث افزایش قلیائیت می شوند.
آشنایی با مفاهیم شاخص های pH و قلیائیت و ارتباط آنها با هم در کاربردهای مختلفی از جمله سیستم های تصفیه آب و نگهداری استخرها از اهمیت ویژه ای برخوردار است.
برای اندازه گیری مقادیر pH و قلیائیت می توان از تست کیت های اندازه گیری این پارامترها که معمولاً بصورت محلولی، نواری و یا پودری هستند، استفاده نموده و برای تنظیم آن ها نیز از مواد شیمیایی مخصوص این کار با دستورالعمل مناسب بهره برد.

نظرات